
As reações de hidrogenação estão entre as mais importantes transformações químicas. Torná-las seletivas, no entanto, para que apenas uma parte da molécula seja hidrogenada, é uma tarefa complicada. Hoje, ela exige a utilização de catalisadores modificados, por exemplo, com chumbo. O novo produto à base de nanopartículas metálicas de ouro, por sua vez, traz uma opção mais eficiente e limpa para a catálise dessas reações, de grande utilidade na indústria de polímeros. Desenvolvido no Instituto de Química da USP (IQ-USP), ele é resultado do projeto de doutorado do aluno Jhonatan Fiorio, em conjunto com a professora Liane Rossi.
A pesquisa da docente com catalisadores à base de ouro teve início há pouco mais de dez anos. Embora pouco utilizado historicamente na área de catálise, devido a sua baixa reatividade, o metal nobre despertou o interesse do grupo de pesquisa da professora por suas propriedades seletivas. “Os relatos que já existiam a respeito do ouro apontavam para uma alta seletividade em reações de oxidação, por exemplo. Ou seja, levando ao produto desejado na reação, e minimizando a formação de outros produtos e subprodutos indesejados”, explica Liane.
Após resultados iniciais bem-sucedidos com reações de oxidação, as quais já estavam sendo estudadas por outros grupos de pesquisa, principalmente na Europa, Liane e sua equipe prosseguiram com experimentos em reações de hidrogenação. Os primeiros testes de aplicação do catalisador nanoparticulado neste segundo processo, porém, apresentaram resultados pífios e distantes do êxito anterior.
Apesar do revés, uma particularidade motivou o prosseguimento das pesquisas com o ouro. Por mais que apenas 1% a 2% do reagente se convertesse nos experimentos iniciais, gerava-se exclusivamente o produto desejado. “Nas mesmas condições, uma reação com paládio levaria a uma conversão total. Porém, com baixa seletividade ao produto desejado, muito provavelmente com hidrogenação total da molécula”, constatou a professora, que viu no ouro uma oportunidade.
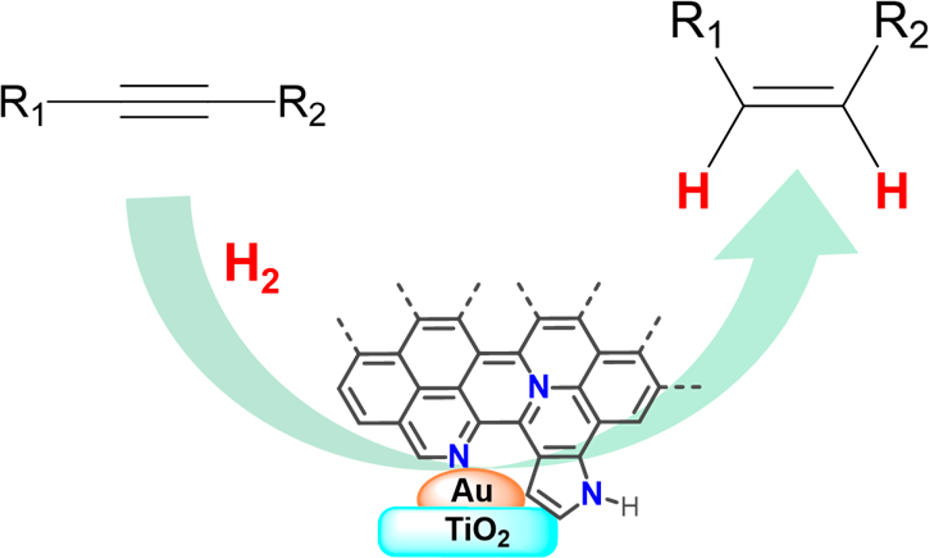
Naquele momento, a atenção estava voltada para as reações de hidrogenação seletiva de alquinos (ligação tripla entre carbonos) para alquenos (ligação dupla entre carbonos). Estudos teóricos já confirmavam que o ouro adsorve em sua superfície, isto é, fixa preferencialmente o alquino, sendo uma oportunidade para processos seletivos nos quais o metal seleciona qual fragmento será reduzido preferencialmente. Portanto, era necessário encontrar uma maneira de ativar a molécula de hidrogênio, que normalmente não adsorve sobre o ouro, para que ocorresse a catálise.
A grande virada
A equipe de laboratório da professora já realizava experimentos com catalisadores de paládio contendo ligantes orgânicos nitrogenados. Ao preparar um análogo de ouro, conseguiram aumentar a conversão da reação de hidrogenação para aproximadamente 20%. Estudos foram desenvolvidos em cima desse resultado, com aplicação de vários outros ligantes nitrogenados, até que se chegou a um sistema com alta conversão.
Foi o primeiro resultado positivo obtido para hidrogenações com ouro, afirma Liane. “Ele (o sistema), de fato, desenvolveu total conversão e total seletividade para o produto que tinha, então, as duplas ligações carbono-carbono preservadas. Com base nisso é que tudo começou. E aí veio a motivação para o estudo do mecanismo da reação, para entender melhor o funcionamento do sistema catalítico, e o desenvolvimento de outros catalisadores.”
Hoje, o que se tem é um análogo, uma versão totalmente heterogênea do catalisador. Os ligantes nitrogenados são pirolisados termicamente em atmosfera inerte, gerando uma “camada” de carbono dopado com átomos de nitrogênio sobre o ouro metálico. O novo sistema apresenta o mesmo tipo de reatividade – com 100% de conversão e seletividade. Este é o produto descrito na patente de invenção, solicitada pela docente e pelo doutorando em março deste ano.
Química verde
As reações de hidrogenação estão entre as mais importantes transformações químicas. Um grande exemplo é a hidrogenação seletiva de alquinos a alquenos, que foi estudada em laboratório pela docente. Essa reação é empregada em grande escala pela indústria de polímeros, a fim de purificar a matéria-prima utilizada no processo de polimerização do etileno para o polietileno, a qual contém até 1% de acetileno. Além disso, é fundamental para a obtenção de alquenos, que são intermediários importantes em síntese orgânica e para a síntese de alguns fármacos.
O paládio, por mais que seja pouco seletivo, ainda é amplamente usado nesse processo. Isso porque foram desenvolvidas estratégias para atenuar sua alta reatividade e aumentar a seletividade na transformação de tripla para dupla ligação entre carbonos. O mais conhecido é o chamado catalisador de Lindlar, cuja metodologia é baseada no envenenamento do metal com chumbo.
Conforme comprovado em laboratório, esse catalisador, quando chega a altas conversões do alquino, também começa a hidrogenar o alqueno, levando à formação de alcanos. Ou seja, ele não é 100% seletivo, a não ser que a reação seja interrompida no momento exato. Além disso, utiliza o chumbo, que é altamente tóxico – muito mais que o ouro ou o paládio – e pode ser transportado, de certa forma, para o produto. Pesa também o fato de que o catalisador de Lindlar desativa com o tempo, sendo necessário seu descarte.
Diferentemente da solução encontrada por Herbert Lindlar, na década de 1950, a alternativa à base de ouro apresenta 100% de seletividade e de conversão na transformação de alquinos em alquenos, sem qualquer formação de subprodutos indesejados. Também é reutilizável em sucessivas reações, sem necessitar de etapas de regeneração, e segue o princípio da química verde, ao não utilizar o chumbo na sua formulação.
O próprio conceito de catálise, área que estuda a aceleração de reações químicas pela ação de catalisadores, caminha ao lado de uma química mais verde por si só, explica Liane. “Quando eu abrevio etapas de reação e purificação, eu também estou indo no caminho de uma química mais limpa. Usar reações catalíticas, fazer reduções empregando catalisadores e gás hidrogênio, que é o redutor nesse caso, vai ser muito mais ambientalmente correto do que você usar redutores estequiométricos, por exemplo.”



Faça um comentário