A perda de memória, a confusão mental e a dificuldade de realizar tarefas simples podem aparecer com o avanço da idade. E quando intensificadas, essas alterações cognitivas podem indicar quadros de doenças neurodegenerativas, como o Alzheimer. Segundo a Organização Mundial da Saúde (OMS), mais de 50 milhões de pessoas possuem a doença e estima-se que mais de 152 milhões de pessoas vivam com algum tipo de demência.
Com a co-autoria do professor Danilo Medinas, do Instituto de Química (IQ) da Universidade de São Paulo (USP), e com o apoio de pesquisadores da Universidade Federal do Rio de Janeiro (UFRJ), o estudo Hevin/SPARCL-1 astrocítico regula o declínio cognitivo no envelhecimento cerebral patológico e normal (2025), publicada recentemente na revista Aging Cell, propõe um olhar inovador sobre as moléculas que regulam o declínio cognitivo. A pesquisa investiga a ação da proteína hevina, secretada por astrócitos (células cerebrais que atuam no suporte e na regulação das funções neuronais), como agente estabilizador das sinapses e potencial alvo terapêutico para o envelhecimento cerebral, tanto em contextos normais quanto patológicos.
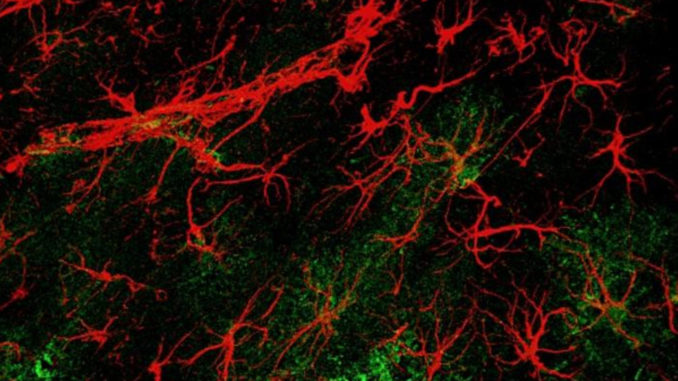
Essencial para a função cognitiva, a comunicação sináptica é responsável pelo processamento de informações pelo cérebro. “A atividade cognitiva depende de sinais dentro de um circuito celular, formados por neurônios conectados. A hevina é uma proteína extracelular que dá suporte aos terminais nervosos. Os neurônios possuem estruturas especializadas, chamadas sinapses, que promovem a comunicação entre uma célula e outra”, explica Medinas.

Os resultados mostraram que a superexpressão da proteína hevina atenuou significativamente o declínio cognitivo. A intervenção aumentou a quantidade de marcadores pré e pós-sinápticos, além de alterar a expressão de mediadores sinápticos. “Seja com o passar do tempo, seja por danos cumulativos, como traumas ou lesões nos vasos cerebrais, o número e a forma de sinapses decaem. Estratégias que promovem ou estabilizam sinapses têm o potencial de frear ou reverter o declínio cognitivo”, aponta o professor.
Dois lados da gangorra
No cérebro, as conexões sinápticas precisam ser ajustadas com precisão. Conexões de menos podem comprometer a memória, enquanto em excesso podem resultar em desorganização do circuito neural. A proteína hevina atua positivamente na estabilização das sinapses, enquanto a proteína SPARC exerce efeito inibitório. “Existe um balanço delicado no nosso cérebro. Muitas conexões também podem ser inadequadas. Se forem excessivas, o sistema entra em curto-circuito”, explica Medinas.
Os astrócitos influenciam a formação, manutenção e poda das sinapses e também oferecem neuroproteção aos neurônios. Sua atuação impacta diretamente na capacidade do cérebro de se adaptar, moldar-se e responder a estímulos ao longo do tempo, conceito conhecido como plasticidade neural.
O pioneirismo em caracterizar atuação da hevina astrocítica também revelou que a molécula é capaz de induzir o desenvolvimento de sinapses estruturalmente formadas, mesmo que, inicialmente, funcionem como sinapses “silenciosas”. Ao interagir com outras moléculas e receptores, essas estruturas podem ganhar funcionalidade, reforçando os circuitos neuronais. Nos casos de Alzheimer, os níveis de hevina caem, o que possivelmente predispõe o paciente à perder sinapses.
Aplicabilidade clínica e terapêutica
O Alzheimer, demência mais comum no mundo, é marcado pela perda neuronal, redução das sinapses e acúmulo de duas proteínas tóxicas: o peptídeo beta-amiloide (Aβ) e a tau hiperfosforilada, que formam placas e emaranhados neurofibrilares no cérebro. A doença também compromete a plasticidade neural, levando ao esquecimento de informações de curto prazo.
A maioria dos estudos de desenvolvimento de terapias que já chegaram aos pacientes de Alzheimer têm como foco o combate ao acúmulo das proteínas tóxicas. Assim, estratégias que busquem combater outras características patológicas, como a perda de sinapses, tem o potencial de atuar de maneira complementar com os tratamentos disponíveis.

Para o professor, o estudo busca desvendar aspectos do mecanismo básico das doenças cognitivas. Ainda em estágio pré-clínico, a pesquisa é promissora não somente por avançar sobre o entendimento e as funcionalidades dos astrócitos, mas também por oferecer possibilidades de futuras abordagens clínicas no tratamento e na prevenção de doenças neurodegenerativas como o Alzheimer.




Faça um comentário