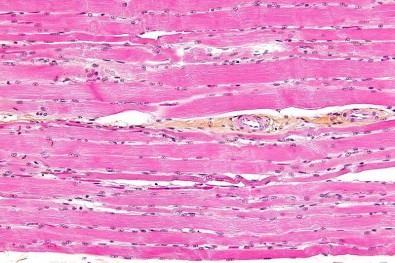
O músculo esquelético aumenta o tamanho e sua força em cerca de 40% quando é introduzido o microRNA através de técnica que o inclui em um plasmídeo na região muscular e estimula ele com eletricidade uma única vez. Como consequência, acaba controlando a massa muscular. Pesquisas feitas o Instituto de Ciências Biomédicas (ICB) da USP revelam que os resultados do processo são evidentes dentro de um mês e podem ajudar a ter um menor risco de contrair a atrofia.
Presente em boa parte do corpo, o músculo esquelético é responsável pela postura e pela realização de movimentos, desempenhando papel fundamental na adaptação do corpo humano ao ambiente. O coordenador da pesquisa, o professor Anselmo Moriscot, exemplifica algumas situações em que as pessoas podem perder massa, como na velhice, ou quando passam muito tempo acamadas e também quando atravessam situação debilitante devido ao câncer.
“A pessoa pode ir perdendo cerca de 10% da massa a cada dez anos. Por exemplo, ela chega aos 80 anos com a massa muscular muito defasada e um risco independente de maior mortalidade”, explica Moriscot. Os estudos então se voltaram a procurar algum microRNA que apresentasse potencial para melhorar o quadro de desgaste do músculo.
Os microRNAs se ligam aos RNAs que transmitem uma mensagem codificada de proteínas para as células do corpo. Eles são uma espécie de RNA menor e não interagem com a mensagem da proteína, mas acabam por inibir a atividade do mensageiro.
Testes feitos em três grupos diferentes de modelos animais introduziram o microRNA29-c e estudaram os efeitos dele sobre o músculo tibial anterior, responsável pela articulação dos pés. A sequência do microRNA foi colocada dentro de um plasmídeo, uma molécula circular do DNA que se reproduz de maneira independente. Depois, quando introduzido no músculo, foram feitos estímulos com eletricidade.
As células da região captaram a presença do plasmídeo e começaram a produzir a sequência de genes inibidores da atrofia muscular de forma constante. A técnica utilizada é a eletrotransferência. Depois de um mês, os pesquisadores viram o aumento proporcional de 40% da massa muscular e também da força, efeito resultante de hipertrofia.
“Temos que entender que quando esse plasmídeo está na célula, ele fica constantemente produzindo o microRNA29-c. Não é como se fosse um remédio que, quando é ingerido e degradado, tem um pico no seu sangue e depois você tem que tomar outro”, compara o coordenador do Laboratório de Plasticidade Muscular do ICB. “Está se usando uma estratégia gênica, introduzindo um vetor que vai ficar produzindo”.
A equipe de pesquisadores fez recentemente testes com o intervalo de tempo de 60 dias. “Nesse caso, usando a eletrotransferência, o ganho também foi igual. É algo que perdura bastante. Não sabemos o quanto que isso dura, mas considerando o modelo animal, é bastante tempo.”
Quando o músculo cresce e aumenta a sua força, como ocorreu nos processos feitos na USP, podem ocorrer dois cenários: o primeiro diz respeito ao acúmulo de proteína dele, quando aumenta a síntese da substância, o segundo é quando esse tecido muscular está diminuindo a degradação das mesmas proteínas. É preferível uma situação onde há equilíbrio entre síntese e degradação.
“A nossa conclusão foi que esse músculo está crescendo porque ele diminui os processos de degradação, muito mais do que um aumento de produção. A degradação é freada com intensidade”, pontua o professor. A pesquisa foi financiada pela Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) e a técnica foi patenteada pela Agência USP de Inovação (AUSPIN), com propriedade intelectual do professor Moriscot e pelo hoje pós-doutorando William Silva.
Uma técnica, diversas contribuições
A descoberta lançou um leque de possibilidades de estudar outras situações com o grupo de pesquisa do Laboratório de Plasticidade Muscular. Há estudos com o período reduzido de 15 dias para ver o desenvolvimento do efeito com o músculo em situação de desafio.
“Fizemos o mesmo processo. Ainda não tem hipertrofia, só em 30 dias. Injetamos células que provocam câncer. Esse modelo entra então em caquexia, uma condição do câncer mais terminal onde a musculatura desaparece muito rápido”, conta Moriscot. Foram aguardados mais 15 dias para completar o ciclo de um mês. Nesse caso, as células cancerígenas foram introduzidas após o processo com o microRNA29-c.
Segundo resultados preliminares com medidas de massa do músculo e de tamanho das células, o músculo apresentou uma certa resistência à situação. “Não temos um estudo molecular disso ainda, mas tivemos como resultado uma ‘boa’ proteção. Ficamos animados. Esse achado está firme, nós repetimos três vezes [o procedimento] e todas as três vezes acontece a mesma coisa”.
Contudo, o professor Anselmo ressalta que são resultados iniciais e que a pesquisa nessa área está em andamento. Ainda têm experimentos sendo feitos com medicamentos com a presença de corticoides e seu uso crônico, que tem como efeito colateral a atrofia muscular, e também em situações em que o músculo fica totalmente imobilizado.
“Mas para a gente pensar em tratamento, estamos falando de anos, de década. Ainda falta avaliar a toxicidade do microRNA29-c no organismo. Qual o impacto que ele tem no osso? No fígado? A gente ainda não sabe. E não dá para utilizar o 29-c no humano com eletrotransferência, em todos os seus músculos. Temos que mudar a entrega dele”. Paralelamente, há um estudo com vírus feito pela equipe de Moriscot para que o procedimento seja viável nos seres humanos.




Faça um comentário